ENLACE IÓNICO :
El enlace iónico es una unión que resulta de la presencia de atracción electrostática entre los iones de distinto signo, es decir, uno fuertemente electropositivo (baja energía de ionización) y otro fuertemente electronegativo (alta afinidad electrónica). Eso se da cuando en el enlace, uno de los átomos capta electrones del otro.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metálico y uno no metálico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationescon una configuración electrónica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto adquieren 8 electrones en su capa más exterior. La atracción electrostática entre los iones de su carga opuesta causa que se unan y hagan un compuesto.
Características de los enlaces iónicos :
* Son sólidos de estructura cristalina en el sistema cúbico.
* Altos puntos de fusión y ebullición .
* Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los grupos VI y VII
* Son solubles , como en agua y otras disoluciones acuosas.
* Una vez fundidos o en solución acuosa, sí conducen la electricidad.
* En estado sólido no conducen la electricidad. Si utilizamos un bloque de sal como parte de un circuito en lugar del cable, el circuito no funcionará. Así tampoco funcionará una bombilla si utilizamos como parte de un circuito un cubo de agua , pero si disolvemos sal en abundancia en dicho cubo, la bombilla del circuito se encenderá. Esto se debe a que los iones disueltos de la sal son capaces de acudir al polo opuesto (a su signo) de la pila del circuito y por ello éste funciona
Imagen de enlace iónico: ( ejemplo = NaCl)
.
Video Sobre enlaces iónicos:
http://www.youtube.com/watch?v=Qth0Y0haV3U
ENLACES COVALENTES
Un enlace covalente se produce al compartir electronesentre dos átomos. Los enlaces covalentes se suelen producir entre elementos gaseosos no metales .
CARACTERÍSTICAS: Existen dos tipos de sustancias covalentes :
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas que tienen las siguientes propiedades:
* Temperaturas de fuisión y ebullición bajas.
* En condiciones normales (25 ºC aprox.) pueden ser sólidos, líquidos o gaseosos
* Son blandos en estado sólido.
* Son aislantes de corriente eléctrica y calor.
* Solubilidad: las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Redes: además las sustancias covalentes forman redes, semejantes a los compuestos iónicos, que tienen estas propiedades:
*Elevadas temperaturas de fusión y ebullición.
*Son sólidos
*Son sustancias muy duras (excepto el grafito).
* Son aislantes (excepto el grafito).
* Son insolubles.
* Son neocloridas
Video de enlaces covalentes :
Imagen del enlace covalente :
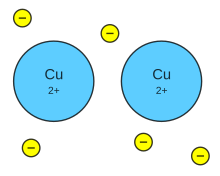
ENLACE METÁLICO :
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre núcleos atómicos y los electrones de valencia, que se agrupan alrededor de éstos como una nube) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas.
Características del enlace metálico :
- Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
- Las conductividades térmicas y eléctricas de los metales son muy elevadas (esto se explica por la enorme movilidad de sus electrones de valencia menor).
- Presentan brillo metálico.
- Son dúctiles y maleables (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse entre sí sin producir una rotura).
- Pueden emitir electrones cuando reciben energía en forma de calor.
- Pueden perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
Video de enlace metálico :
Imagen enlace metálico :


ok tarea.
ResponderEliminar8